移植腎が廃絶する原因で最も多いのがABMRであり、ABMRの治療は難しい。抗体による疾患と言う意味では自己免疫疾患に似ているし、抗体産生の元がB細胞や形質細胞であるという意味では血液疾患にも似ている。下図のようにさまざまな治療ターゲットについてさまざまな治療が行われ(試され)ているが、効果と安全性は一貫していない。
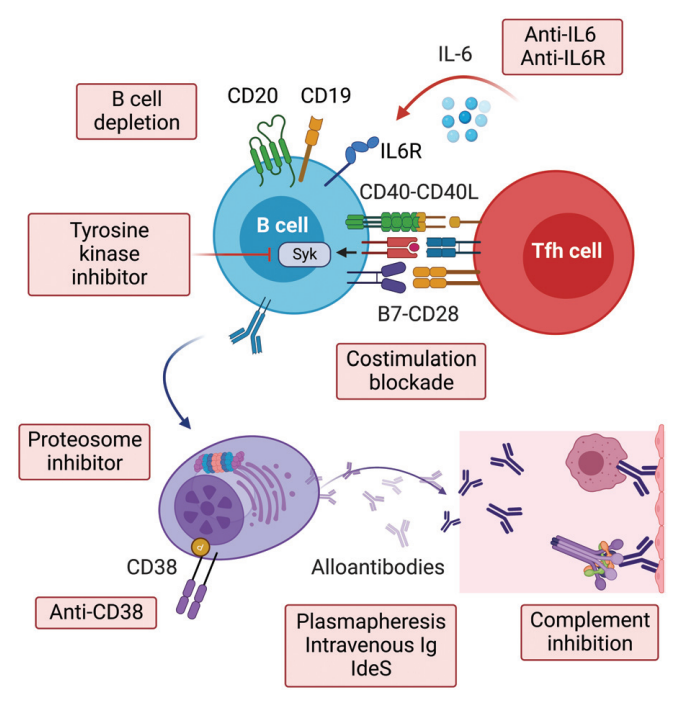 |
| (出典はCurr Opin Organ Transplant 2022 27 405) |
このなかで、現在よく行われるのは血漿交換とIVIGである。血漿交換は血漿量×1‐1.5の除去を連日または隔日×4‐6回、IVIGは血漿交換ごとに100‐200mg/kg、または単独で2g/kgが通例である。
なおエキスパート・コンセンサス(Transplantation 2020 104 911)はステロイドも標準治療に載せている。経験的なものであるが、上図のようにB細胞の活性化にはT細胞(とくにfollicular helper、Tfh cell)が重要である。また、純粋なABMRということはあまりなく、多くはTCMRを合併している。そのため、Thymoが併用されることもある。
抗体そのものをターゲットにした治療に、IdeS(imlifidase)がある。IdeSはStreprococcus pyogenesで見つかったIgG全クラスの重鎖を切断する酵素に由来し、腫瘍崩壊症候群の高尿酸血症に対するrasburicaseのように、一時的に血中のIgGを激減させる。現在は移植直前の脱感作に用いられているが、ABMRにも治験されている(NCT03897205)。
次に標準的になりつつあるのがRTXで、375mg/m2の単回投与が通例である。よく引用されるエビデンスのRITUX-ERAH試験(Transplantation 2016 100 391)は、血漿交換3回+IVIGを受けた38例のABMR患者をRTX群とプラセボ群に分け、その後血漿交換2回+IVIGを行ったものだ。12か月後のグラフト機能・予後に有意差はなかったが、プラセボ群の8例もrescue therapyとしてRTXを受けたので、解釈は難しい。ステロイド併用例にRTXを追加した効果を調べる治験が進行中である(NCT03994783)。
また、抗CD20モノクローナル抗体でRTXよりもヒト化されたObinutuzumabも、RTXよりも効きそう?というわけで試されることがある。
他にB細胞をターゲットにした治療に、syk(spleen tyrosine kinase)阻害薬のFostamatinib、抗IL-6受容体モノクローナル抗体のTocilizumab、抗IL-6モノクローナル抗体のClazakizumabなどが試みられているほか、DSAを減らす効果のあるBelataceptのBELACOR試験(Am J Transplant 2019 19 894)も行われている。
しかし、感作されたB細胞は、メモリーB細胞や形質芽球、形質細胞に分化してしまう(下図)。そこで、Bortezomib、抗CD38モノクローナル抗体Felzartamabなど、骨髄腫に用いられてきた薬が治験されている。Felzartamabの第2相結果は7月11日に発表され(NEJM 2024 391 122)、安全性はacceptableであった。
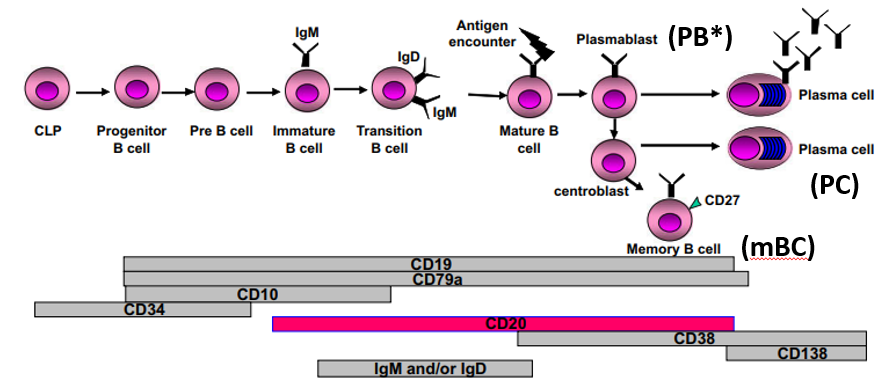 |
| (出典はBiol Blood Marrow Transplant 2009 15 104-113、*形質芽球はCD20陰性) |
なお、CD38は炎症の主役であるNK細胞にもあることから、抗体産生だけでなく拒絶反応を緩和する効果も期待されている。
抗体が血管内皮細胞に結合した後の補体反応を抑える治療に、C5ないしC1をターゲットにしたものがある。抗体は消せなくても、補体反応を抑えればそこで傷害をシールドできるから大丈夫、という考え方である。
C5についてはモノクローナル抗体eculizumabが試されている。よく知られているのは、移植前後に何十回も血漿交換で脱感作しても3週以内に重度のABMRを起こした患者5例に、脾摘とeculizumabを併用したところ、1例のグラフト廃絶もtransplant glomerulopathyも起きなかったという報告である(Transplant 2014 98 857)。DSAは消えなかったが、補体反応はシールドできることが実証された。
しかし、患者には尿路感染症(80%)、肺炎(40%)、CMV血症(20%)、菌血症ないし敗血症(40%)、皮膚軟部組織感染症(60%)、C. diff感染症(60%)などが起き、これらは脾摘単独やeculizumab単独に比べて多い結果だった。
「ふたつよいこと、さてないものよ」とはよく言ったものだが、現時点では最終兵器の位置づけである。今後、長時間作用の第二世代ravulizumabなども試されるかもしれない。
抗C1治療には、C1-INH(Cinryze®とBerinert®)と、抗C1モノクローナル抗体Sutimlimabがあり、それぞれ遺伝性血管浮腫、寒冷凝集素症に認可されている。
C1-INHは標準治療にadd-onして6ヵ月後の腎生検でtransplant glomerulopathyが診らなかったという報告はある(AJT 2016 16 3468)が、その後のRCTは有効性が示せず中止されている。
Sutimlimabは第1相試験で腎機能に変化はなかったが、患者の多くで腎病理のC4d沈着が消えていた(AJT 2018 18 916)。現在、第2相試験が行われている(NCT05156710)。
・・ここまで、さまざまな治療選択肢を紹介したが、これだけ知っていても「こういうときにはどうしよう?」という治療戦略はわからない。それは診療経験を積む中で培うしかないとも言えるが、次回はその参考になるかもしれない、さまざまな免疫学的リスク因子についてまとめたい。